二碘化钨反应标准摩尔焓变是多少?
- 详细资料
- 分类:钨业知识
- 发布于 2023年7月09日 星期日 13:04
- 作者:Shuangfeng
- 点击数:2083
二碘化钨(WI2)的反应的标准摩尔焓变是-70.61 kJ/mol。它是指在标准状态下,1 mol的WI2形成所需要的反应物质(即W和I2)与其对应的反应产物(即WI2气体)之间的热力学能量变化。具体地,二碘化钨的反应生成焓可以通过测定钨、碘和二碘化钨的标准摩尔生成焓,该值可通过实验测量获得。
一种常用的方法是使用卡路里计量法,以WI2的标准摩尔生成焓为例,将已知质量的WI2固体加入一个恒定温度的热容器中,并与已知量的氧气反应,从而测量反应过程中释放或吸收的热量(即反应热)。然后可以使用标准反应焓值来计算WI2的标准摩尔生成焓,这个过程可以用下列方程式表示:
W(s) + I2(g) ==WI2(g); ΔrHmθ =?
其中,W(s)代表固态钨,I2(g)代表气态碘,WI2(g)代表气态二碘化钨。
反应的生成焓ΔrHmθ可以通过应用热力学第一定律,即能量守恒定律来计算。根据这个定律,反应的ΔrHmθ等于反应物的标准生成焓之和减去产物的标准生成焓之和,即
ΔrHmθ(WI2,g)= ΔfHmθ(WI2,g) -ΔfHmθ(I2,g)- ΔfHmθ(W,s)
其中,ΔfHmθ表示标准生成焓,系数代表产物和反应物中各物质的摩尔数。
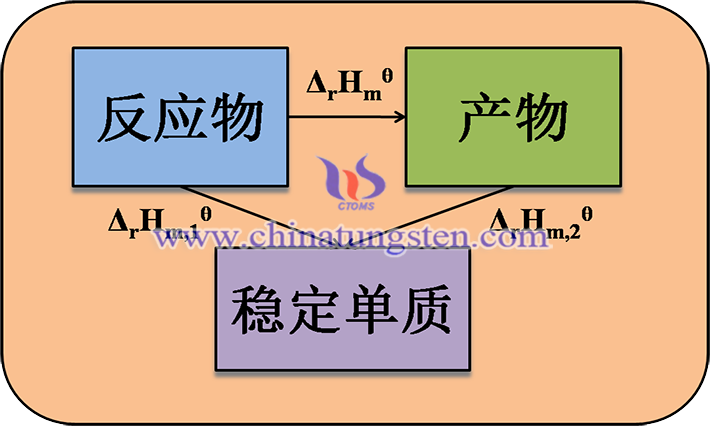
对于本反应来说,反应物是钨和碘,产物是二碘化钨。它们的标准生成焓如下:
ΔfHmθ(W,s) = 0 kJ/mol
ΔfHmθ(I2,g) = 62.24 kJ/mol
ΔfHmθ(WI2,g) =-8.37 kJ/mol
将这些值代入上述公式,可以计算出二碘化钨的生成焓为:
ΔrHmθ(WI2,g)= ΔfHmθ(WI2,g) -ΔfHmθ(I2,g)- ΔfHmθ(W,s)
= [-8.37] - [0 + 62.24]
= -70.61 kJ/mol
因此,在标准状态下,1 mol的钨和1 mol的碘反应生成1 mol的二碘化钨所释放的热量为70.61 kJ/mol。
| 氧化钨供应商:中钨在线科技有限公司 | 产品详情: http://www.tungsten-oxide.com |
| 电话:0592-5129696 传真:5129797 | 电子邮件:sales@chinatungsten.com |
| 钨钼文库:http://i.chinatungsten.com | 钨钼图片: http://image.chinatungsten.com |
| 钨业协会:http://www.ctia.com.cn | 钼业新闻: http://news.molybdenum.com.cn |




