二碘化鎢反應標準摩爾焓變是多少?
- 詳細內容
- 分類:鎢的知識
- 發佈於:2023-07-09, 週日 13:04
- 作者 Shuangfeng
- 點擊數:836
二碘化鎢(WI2)的反應的標準摩爾焓變是-70.61 kJ/mol。它是指在標準狀態下,1 mol的WI2形成所需要的反應物質(即W和I2)與其對應的反應產物(即WI2氣體)之間的熱力學能量變化。具體地,二碘化鎢的反應生成焓可以通過測定鎢、碘和二碘化鎢的標準摩爾生成焓,該值可通過實驗測量獲得。
一種常用的方法是使用卡路里計量法,以WI2的標準摩爾生成焓為例,將已知品質的WI2固體加入一個恒定溫度的熱容器中,並與已知量的氧氣反應,從而測量反應過程中釋放或吸收的熱量(即反應熱)。然後可以使用標準反應焓值來計算WI2的標準摩爾生成焓,這個過程可以用下列方程式表示:
W(s) + I2(g) ==WI2(g); ΔrHmθ =?
其中,W(s)代表固態鎢,I2(g)代表氣態碘,WI2(g)代表氣態二碘化鎢。
反應的生成焓ΔrHmθ可以通過應用熱力學第一定律,即能量守恆定律來計算。根據這個定律,反應的ΔrHmθ等於反應物的標準生成焓之和減去產物的標準生成焓之和,即
ΔrHmθ(WI2,g)= ΔfHmθ(WI2,g) -ΔfHmθ(I2,g)- ΔfHmθ(W,s)
其中,ΔfHmθ表示標準生成焓,係數代表產物和反應物中各物質的摩爾數。
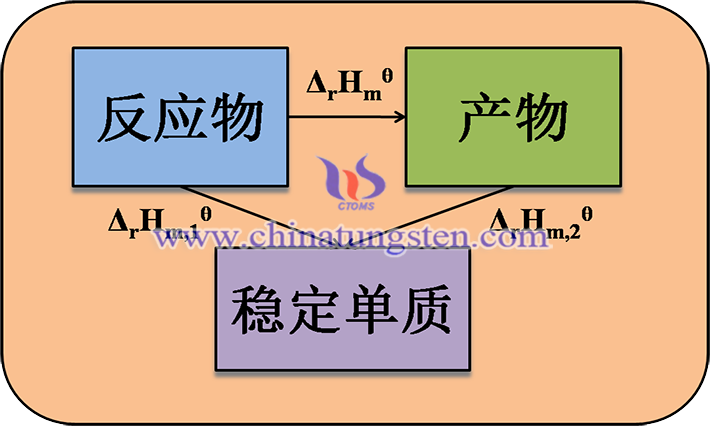
對於本反應來說,反應物是鎢和碘,產物是二碘化鎢。它們的標準生成焓如下:
ΔfHmθ(W,s) = 0 kJ/mol
ΔfHmθ(I2,g) = 62.24 kJ/mol
ΔfHmθ(WI2,g) =-8.37 kJ/mol
將這些值代入上述公式,可以計算出二碘化鎢的生成焓為:
ΔrHmθ(WI2,g)= ΔfHmθ(WI2,g) -ΔfHmθ(I2,g)- ΔfHmθ(W,s)
= [-8.37] - [0 + 62.24]
= -70.61 kJ/mol
因此,在標準狀態下,1 mol的鎢和1 mol的碘反應生成1 mol的二碘化鎢所釋放的熱量為70.61 kJ/mol。
| 氧化鎢供應商:中鎢在線科技有限公司 | 產品詳情: http://www.tungsten-oxide.com |
| 電話:0592-5129696 傳真:5129797 | 電子郵件:sales@chinatungsten.com |
| 鎢鉬文庫:http://i.chinatungsten.com | 鎢鉬圖片: http://image.chinatungsten.com |
| 鎢業協會:http://www.ctia.com.cn | 鉬業新聞: http://news.molybdenum.com.cn |





 sales@chinatungsten.com
sales@chinatungsten.com